GuruOnlinee.com – Halo sobat cerdas, dalam artikel ini kita akan membahas materi tentang Stoikiometri Senyawa. Apa sih itu Stoikiometri Senyawa? Untuk mengetahuinya, yuk simak penjelasan berikut!
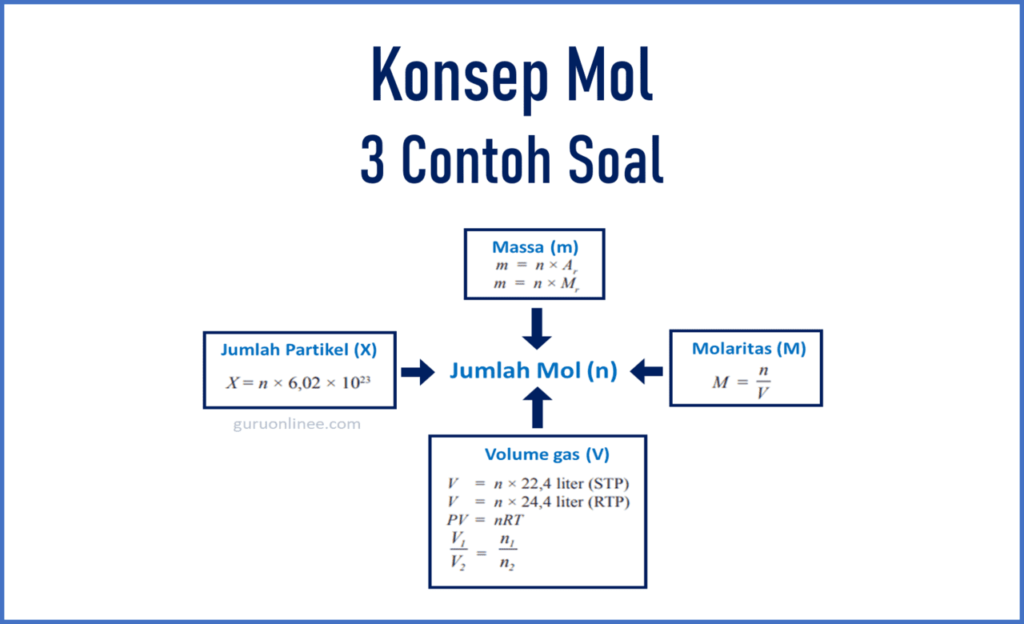
Stoikiometri adalah suatu ilmu kimia yang mempelajari mengenai kuantitas yang terdapat di dalam suatu zat, misalnya seperti massa, volume, jumlah mol, dan jumlah partikel.
Jadi stoikiometeri senyawa membahas tentang massa, volume, jumlah mol, dan jumlah partikel yang terkandung dalam suatu zat.
A. Komposisi Zat
Identifikasi zat dapat dilakukan dengan cara analisis kualitatif dan analisis kuantitatif. Analisis kualitatif digunakan untuk menentukan komponen penyusun zat. Sedangkan analisis kuantitatif digunakan untuk menentukan massa dari setiap komponen penyusun zat.
Komposisi zat dinyatakan dalam persen massa (% mass). Berikut rumus persen massa :
![]()
Contoh
Seseorang menemukan sampel seberat 65 gram yang mengandung 48 gram karbon, 9 gram hidrogen, dan 8 gram oksigen. Komposisi zat tersebut dalam persen massa adalah . . .
Karbon (C)
![]()
![]()
![]()
Hidrogen (H)
![]()
![]()
![]()
Oksigen (O)
![]()
![]()
![]()
B. Komposisi Zat secara Teoritis
Komposisi zat secara teoritis merupakan komposisi zat yang ditentukan dari rumus kimianya. Untuk zat berupa senyawa, komposisinya secara teoritis dapat dinyatakan dalam persen massa unsur dalam senyawa.
![]()
Keterangan :
Ar : massa atom relatif (gram/mol)
Mr : massa senyawa relatif (gram/mol)
Contoh
Tentukan persen massa unsur C, H, dan O dalam senyawa glukosa (C6H12O6) (Ar C = 12, H = 1, dan O = 16)! Jika massa molekul relatif C6H12O6 = 180
Karbon (C)
![]()
![]()
![]()
Hidrogen (H)
![]()
![]()
![]()
Oksigen (O)
![]()
![]()
![]()
C. Menentukan Rumus Kimia Zat
Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris dapat ditentukan dengan menghitung mol komponen penyusun zat dengan menggunakan massa molar. Sedangkan rumus molekul dapat ditentukan jika rumus empiris dan massa molekul relatif (Mr) zat diketahui.
1. Menentukan Rumus Empiris Zat
Untuk menentukan rumus empiris, perbandingan mol unsur-unsur dalam zat haruslah merupakan perbandingan paling sederhana.
Contoh
Sejumlah sampel zat mengandung 11,2 gram Fe dan 4,8 gram O (Ar Fe = 56 dan O = 16). Tentukan rumus empiris senyawa tersebut!
Besi (Fe)
![]()
![]()
![]()
Oksigen (O)
![]()
![]()
![]()
Sehingga perbandingan Fe : O = 0,2 : 0,3 = 2 : 3
Maka, rumus empiris senyawa adalah Fe2O3
2. Menentukan Rumus Molekul Zat
Pada dasarnya rumus molekul merupakan kelipatan-kelipatan dari rumus empirisnya. Sebagai contoh:
| Rumus Molekul | Rumus Empiris | n | Nama Zat |
| H2O | H2O | 1 | Air |
| CO2 | CO2 | 1 | Karbon dioksida |
| C2H2 | CH | 2 | Gas Asetilena |
| C2H4 | CH2 | 2 | Etena |
| C6H14 | C3H7 | 2 | Heksana |
| CH3COOH | CH2O | 2 | Asam asetat |
| C6H12O6 | CH2O | 6 | Glukosa |
| NaCl | NaCl | 1 | Natrium klorida |
| CO(NH2)2 | CO(NH2)2 | 1 | Air |
Berikut persamaan untuk menentukan rumus molekul:
![]()
Keterangan :
n : bilangan bulat
Nilai n dapat ditentukan jika rumus empiris dan massa molekul relatif (Mr) zat diketahui.
![]()
Contoh
Suatu senyawa dengan rumus empiris CH (Ar C = 12 dan H = 1) mempunyai Mr = 26. Tentukan rumus molekul senyawa tersebut!
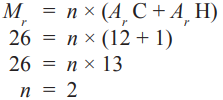
Jadi, rumus molekul senyawa tersebut adalah (CH)2 = C2H2
Demikianlah pembahasan kita terkait stoikiometri senyawa. Terima kasih, semoga bermanfaat.