GuruOnlinee.com – Halo sobat cerdas, dalam artikel ini kita akan membahas Konsep Mol. Apa sih itu Mol? Bagaimana cara menyelesaikan soal-soal yang berkaitan dengan mol? Untuk mengetahuinya, yuk simak penjelasan berikut!
Mol merupakan satuan jumlah zat. Satu mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram C-12, yaitu 6,02 x 1023 partikel. Jumlah partikel tersebut disebut sebagai bilangan Avogadro.
![]()
Jadi, 1 mol zat mengandung 6,02 x 1023 partikel. Mol disimbolkan dengan huruf n.
Contoh :
- 1 mol besi (Fe) mengandung 6,02 x 1023 atom besi
- 5 mol CO2 mengandung 5 x 6,02 x 1023 = 3,01 x 1024 molekul CO2
A. Hubungan Mol (n) dengan Jumlah Partikel (X)
Satu mol zat terdiri dari 6,02 x 1023 partikel, sehingga semakin banyak jumlah mol suatu zat maka semakin banyak pula jumlah partikel yang terkandung dalam zat tersebut.
Dengan kata lain, jumlah mol berbanding lurus dengan jumlah partikel. Secara matematis dapat ditulis :
![]()
atau
![]()
Keterangan :
X : Jumlah Partikel
n : Jumlah Mol
Rumus tersebut menunjukkan bahwa semakin banyak jumlah mol suatu zat, maka jumlah partikel yang terkandung dalam zat tersebut juga semakin banyak.
B. Massa Molar
Massa molar (mm) merupakan massa yang dimiliki oleh 1 mol zat. Massa 1 mol zat sama dengan massa molekul relatif (Mr) zat tersebut dengan satuan gram/mol.
Unsur yang partikelnya berupa atom, maka massa molar sama dengan Ar (massa atom relatif) dalam satuan gram/mol.
Contoh
- Massa molar Ca = massa dari 1 mol Ca = Ar Ca = 40 gram/mol
- Massa molar Fe = massa dari 1 mol Fe = Ar Fe = 56 gram/mol
Catatan : Massa Ar untuk setiap unsur dapat dilihat pada Tabel Periodik
Sementara unsur yang partikelnya berupa molekul dan senyawa, maka massa molar sama dengan Mr (massa molekul relatif) dalam satuan gram/mol.
Berikut rumus massa molekul relatif :
![]()
Keterangan :
Mr : Massa molekul relatif (gram/mol)
Ar : Massa atom relatif (gram/mol)
Contoh

Adapun rumus hubungan jumlah mol (n) dengan massa zat (m) dapat ditulis seperti berikut:
![]()
atau
![]()
atau
![]()
Keterangan :
m : Massa zat (gram)
n : Jumlah mol (mol)
mm : Massa molar = Ar atau Mr (gram/mol)
Sehingga rumus banyak mol dapat ditulis menjadi :
![]()
C. Volume Molar Gas
Hipotesis Avogadro menyatakan bahwa jumlah partikel semua gas akan sama jika suhu, tekanan dan volumenya sama. Volume per mol gas disebut volume molar (Vm) . Secara matematis dapat ditulis:
![]()
Keterangan :
V : Volume gas (liter)
n : Jumlah mol (mol)
Vm : Volume molar (liter/mol)
Volume molar gas bergantung pada suhu dan tekanan. Beberapa keadaan suhu dan tekanan yang biasa dijadikan acuan penentuan volume gas sebagai berikut.
1. Keadaan Standar
Keadaan Standar atau Standard Temperature and Pressure (STP) adalah kondisi dengan suhu 0 oC dan tekanan 1 atm. Berikut perhitungan STP :
![]()
Keterangan :
P : Tekanan (atm)
V : Volume gas (liter)
n : Jumlah mol (mol)
R : tetapan gas = 0,082 L atm/mol K
T : 0 oC = 273 K
Dengan menggunakan rumus tersebut, volume molar dapat ditentukan dengan cara :
![]()
![]()
![]()
Jadi, pada keadaan standar (STP), volume molar (volume 1 mol gas) adalah 22,4 liter/mol.
2. Keadaan Kamar
Keadaan kamar atau Room Temperature and Pressure (RTP) adalah kondisi dengan suhu 25 oC dan tekanan 1 atm. Berikut perhitungan RTP :
![]()
Keterangan :
P : Tekanan (atm)
V : Volume gas (liter)
n : Jumlah mol (mol)
R : tetapan gas = 0,082 L atm/mol K
T : 25 oC = 298 K
Dengan menggunakan rumus tersebut, volume molar dapat ditentukan dengan cara :
![]()
![]()
![]()
Jadi, pada keadaan kamar (RTP), volume molar (volume 1 mol gas) adalah 24,4 liter/mol.
3. Keadaan Tertentu
Volume gas pada suhu dan tekanan yang diketahui dapat dihitung dengan menggunakan persamaan gas yang disebut persamaan gas ideal. Persamaan gas ideal, yaitu PV = nRT, untuk menentukan volume gas maka:
![]()
Keterangan :
P : Tekanan (atm)
V : Volume gas (liter)
n : Jumlah mol (mol)
R : tetapan gas = 0,082 L atm/mol K
T : Suhu (K)
4. Keadaan yang Mengacu pada Keadaan Gas Lain
Pada suhu dan tekanan yang sama, volume gas hanya bergantung pada jumlah molnya. Misalkan gas pertama dengan jumlah mol n1 dan volume V1 dan gas kedua dengan jumlah mol n2 dan volume V2, maka pada suhu dan tekanan yang sama berlaku:
![]()
D. Molaritas
Molaritas (M) adalah ukuran konsentrasi atau kepekatan suatu larutan. Molaritas menyatakan jumlah mol zat terlarut dalam tiap liter larutan. Satuan molaritas adalah mol/liter atau mmol/mL.
![]()
Keterangan :
M : Molaritas (mol/liter)
n : Jumlah mol (mol)
V: Volume (liter)
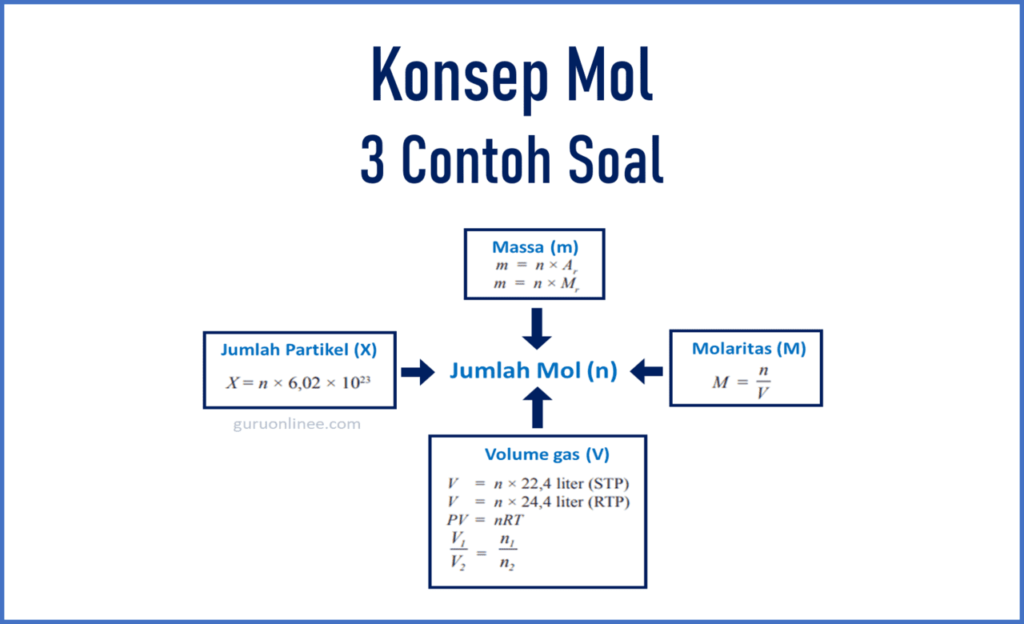
Berikut rangkuman rumus yang menghubungkan antara jumlah mol dengan massa, molaritas, jumlah partikel, dan volume gas.
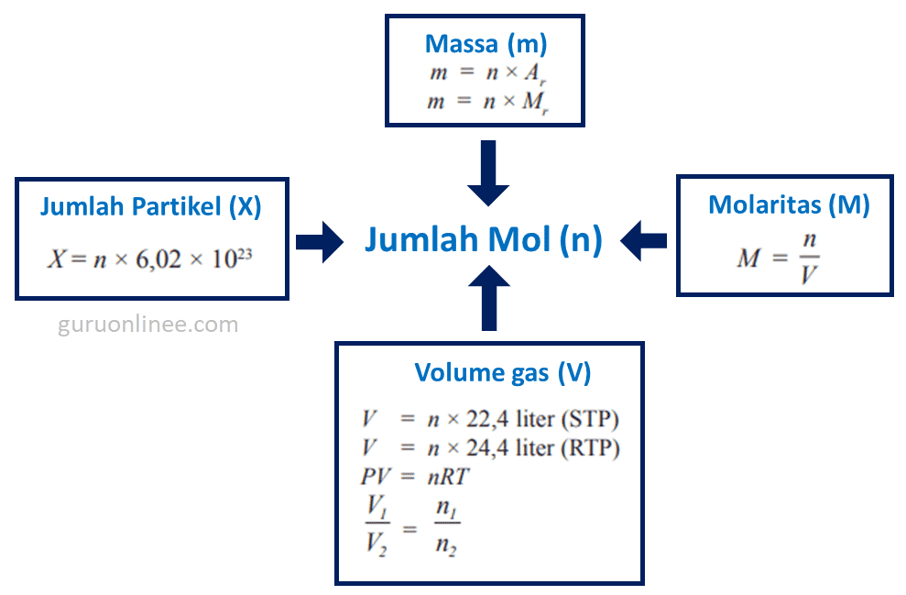
Contoh Soal
1. Hitunglah massa 5 mol besi (Fe) jika Ar Fe sama dengan 56!
Jawab :
Diketahui :
n = 5 mol
Ar Fe = 56
![]()
![]()
![]()
2. Hitunglah massa 0,75 mol urea CO(NH2)2 jika Ar (C=12, O=16, N=14, H=1)!
Jawab :
Diketahui:
n = 0,75
Ar (C=12, O=16, N=14, H=1)
Rumus :
![]()
hitung Mr terlebih dahulu!
![]()
![]()
![]()
Maka,
![]()
![]()
3. Tentukan volume dari 2 mol gas nitrogen jika diukur pada suhu dan tekanan yang sama dimana 0,5 mol gas oksigen mempunyai volume 15 liter.
Jawab :
Diketahui :
n1 = 2 mol
n2 = 0,5 mol
V2 = 15 liter
V1 = . . . ?
Rumus :
![]()
![]()
![]()
Demikianlah pembahasan kita terkait konsep mol. Terima kasih, semoga bermanfaat.